ALCOHOLES Y FENOLES
LAURA MILENA HERRERA MONTAÑA
PRESENTADO A LA DOCENTE: DIANA FERNANDA JARAMILLO
CÁRDENAS
EN LA ASIGNATURA DE: QUÍMICA
GRADO:11-3
INSTITUCIÓN EDUCATIVA EXALUMNAS DE LA PRESENTACIÓN
IBAGUE-TOLIMA
2018
INTRODUCCIÓN
- Reconocer que los alcoholes son compuestos organicos
- Los fenoles son derivados del benceno
- Reconocer que se le nombra fenol al compuesto unido al anillo bencenico
OBJETIVOS
- Saber como se nombran los alcoholes
- Saber como se nombran los fenoles
- Aprender a clasificar los Alcoholes y fenoles
- Conocer el criterio de clasificación de los alcoholes
- Conocer la diferente nomenclatura
MARCO TEÓRICO
Los alcoholes son un grupo de moléculas orgánicas caracterizadas por la presencia de uno o mas grupos -OH (hidroxilo) como grupo principal. Los alcoholes tienen de formula general: R-OH, estructuralmente son semejantes al agua, en donde uno de los hidrógenos se ha sustituido por un grupo alquilo. Su grupo funcional es el grupo hidroxilo, OH.
Los alcoholes son compuestos orgánicos muy comunes en la naturaleza, que juegan roles importantes en los organismos vivientes, especialmente en la síntesis orgánica.
Su nombre proviene del árabe al-kul, que literalmente traduce “espíritu” o “líquido destilado”, ya que los antiguos alquimistas musulmanes perfeccionaron los métodos de destilación del mismo en el siglo IX. Estudios posteriores permitieron conocer su naturaleza química, especialmente los aportes de Lavoisier respecto a la fermentación de la levadura de cerveza.
La ingesta de alcoholes tiene efectos tóxicos sobre el organismo humano, en algunos casos induciendo a la embriaguez y actuando como desinhibidor de la conducta, pero también como depresor del Sistema Nervioso Central (es el caso del etanol).
En otros casos, surten un efecto nocivo y posiblemente letal, dependiendo de la dosis consumida. Sin embargo, también tienen propiedades antibacterianas y antisépticas, que permiten usos superficiales.
ESTRUCTURA
La estructura de un alcohol se asemeja a la del agua puesto que un alcohol procede de la sustitución formal de uno de los hidrógenos del agua por un grupo alquilo.
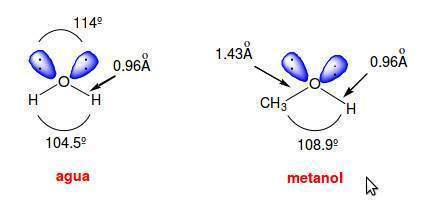
En el agua el ángulo del enlace H-O-H es de 104.5o y el ángulo que forman los dos pares de electrones no compartidos es de 114o. Estos ángulos de enlace se pueden explicar admitiendo una hibridación sp3 en el átomo de oxígeno. No hay ninguna razón para que un átomo (oxígeno, nitrógeno, carbono, etc) forme un conjunto de orbitales híbridos equivalentes cuando no todos los orbitales se van a utilizar del mismo modo. En el agua los orbitales híbridos sp3 que se van a emplear en los enlaces con los átomos de hidrógeno tienen un menor carácter s, lo que explica la disminución del ángulo de enlace tetraédrico desde 109.5o a 104.5o. Por otra parte, los dos orbitales híbridos sp3, que contienen a los dos pares de electrones no enlazantes, tienen un mayor carácter s, lo que explica el aumento del ángulo de enlace desde 109.5o a 114o. El aumento del ángulo de enlace entre los pares de electrones no compartidos tiene un efecto estabilizante al disminuir la repulsión electrónica entre los mismos.
En el metanol el ángulo del enlace C-O-H es de 108.9o. Este ángulo es mayor que en el agua debido a la presencia del grupo metilo, mucho más voluminoso que el átomo de hidrógeno, que contrarresta el efecto de compresión del ángulo de enlace que provocan los dos pares de electrones no enlazantes.
Las longitudes de enlace O-H son aproximadamente las mismas en el agua que en los alcoholes, pero la distancia de enlace C-O es bastante mayor (1.4 Å) debido al mayor radio covalente del carbono en comparación con el del hidrógeno.
TIPOS DE ALCOHOLES
En principio, los alcoholes pueden clasificarse de acuerdo al número de radicales carbonilo que presenten. Así, se distingue entre los alcoholes (un radical) y los polialcoholes o polioles, que presentan dos o más.
Sin embargo, la principal distinción entre los alcoholes depende de su estructura atómica en torno al átomo de carbono del carbinol, de la siguiente manera:
- ALCOHOLES PRIMARIOS:
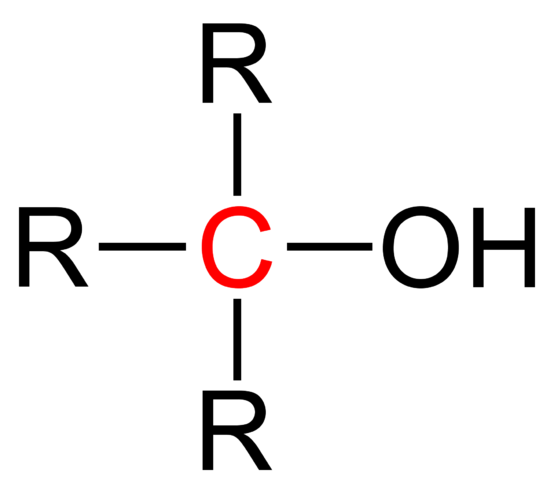
Un alcohol primario es un alcohol que tiene el grupo hidroxilo conectado a un átomo de carbono primario. También se puede definir como una molécula que contiene un grupo “–CH2OH”.En contraste, un alcohol secundario tiene una fórmula "-CHROH" y un alcohol terciario tiene una fórmula “–CR2OH”, donde "R" indica un grupo que contiene carbono.
Ejemplos de alcoholes primarios incluyen etanol y butanol.
ETANOL BUTANOL


Algunas fuentes incluyen metanol como alcohol primario, que incluye la edición de 1911 de la Enciclopedia Británica,pero esta interpretación es menos común en los textos modernos.
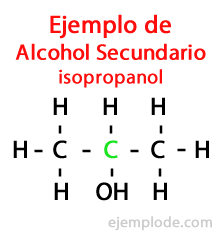
- ALCOHOL SECUNDARIO:
Hablamos de alcohol secundario para designar un alcohol que tiene, además de sus átomos de hidrógeno y oxígeno, dos átomos de carbono unidos a ellos. El alcohol isopropílico y ciclohexanol son alcoholes secundarios. Los alcoholes secundarios se utilizan como desengrasantes. También se encuentran en productos desinfectantes, disolventes o decapantes. Los alcoholes secundarios se añaden en algunos combustibles. Pueden formar parte de las composiciones de productos antisépticos o de masajes.
- ALCOHOL TERCIARIO:
Un alcohol terciario es aquel en el cual el grupo hidroxilo, OH, se halla enlazado a un carbono terciario. Su fórmula continúa siendo ROH, al igual que otros alcoholes; pero se le reconoce fácilmente porque el OH está cercano a una X en la estructura molecular. Asimismo, su cadena carbonada suele ser más corta, y su masa molecular mayor.
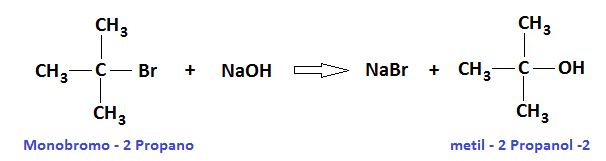
Entonces, un alcohol terciario tiende a ser más pesado, es más ramificado, y además es de todos el menos reactivo respecto a la oxidación; esto es, no puede transformarse en una cetona o ácido carboxílico como ocurre con los alcoholes secundarios y primarios, respectivamente.
NOMENCLATURA:
1. Se elige como cadena principal la de mayor longitud que contenga el grupo -OH.





2. Se numera la cadena principal para que el grupo -OH tome el localizador más bajo. El grupo hidroxilo tiene preferencia sobre cadenas carbonadas, halógenos, dobles y triples enlaces.
3. El nombre del alcohol se construye cambiando la terminación -o del alcano con igual número de carbonos por -ol
4. Cuando en la molécula hay grupos grupos funcionales de mayor prioridad, el alcohol pasa a serun mero sustituyente y se llama hidroxi-. Son prioritarios frente a los alcoholes: ácidos carboxílicos, anhídridos, ésteres, haluros de alcanoilo, amidas, nitrilos, aldehídos y cetonas.
5. El grupo -OH es prioritario frente a los alquenos y alquinos. La numeración otorga el localizador más bajo al -OH y el nombre de la molécula termina en -ol.
PROPIEDADES FÍSICAS DE LOS ALCOHOLES:
Se basan principalmente en su estructura. El alcohol esta compuesto por un alcano y agua. Contiene un grupo hidrofóbico (sin afinidad por el agua) del tipo de un alcano, y un grupo hidroxilo que es hidrófilo (con afinidad por el agua), similar al agua. De estas dos unidades estructurales, el grupo –OH da a los alcoholes sus propiedades físicas características, y el alquilo es el que las modifica, dependiendo de su tamaño y forma.
PROPIEDADES QUÍMICAS DE LOS ALCOHOLES:
Reacción como bases El grupo hidroxilo de los alcoholes puede ser reemplazado por diversos aniones ácidos reaccionando, por lo tanto, como una base según la ecuación general siguiente, en la que se obtiene un haluro de alquilo como producto: H2 R - OH + H - X → R - X + O.
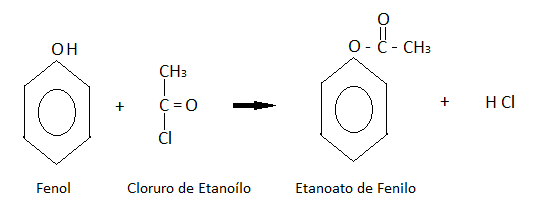
FENOLES
Recibe el nombre de fenol, el alcohol monohidroxílico derivado del benceno; dándosele, además, a todos los compuestos que tengan un radical oxidrílico unido al anillo bencénico. El fenol fue obtenido por Ruge en 1834; separó del asfalto lo que Él llamó ácido carbólico. Nombre con el que se conoció hasta principios de este siglo. En 1914 Meyers y Bergius, proponen hidrolizar el monoclorobenceno con hidróxido de sodio. Proceso que se generalizó pocos años después. Hasta la Primera Guerra Mundial, solo se había logrado obtener el fenol o ácido carbólico por la separación del asfalto; hasta que se estableció el proceso basado en la sulfonación del benceno hidrolizado con hidróxido de sodio, y volviendo a hidrolizar el producto, que era el bencensulfonato de sodio; a este se le llamó fenol sintético. En 1930, se transforma el proceso de hidrólisis del monoclorobenceno, obteniéndose el fenol, en fase vapor, hidrolizando al monoclorobenceno con agua, en lo que se conoce momo proceso de Rashig-Hooker. En 1950, la B.P. Internacional. Ltd. y la Hercules Chemical, Inc., instituyen un nuevo proceso para la obtención del fenol, oxidando el cumeno hasta hidroperóxido de cumeno y catalizando la reacción de éste para obtener fenol y un segundo producto comercial, la acetona. Este proceso surgió debido a la sobreproducción del cumeno que era subproducto en la reacción de obtención del hule sintético G R - S, además de la necesidad de la obtención de acetona que se usaba como aditivo en gasolinas de aviación. En 1961, se busca reformar los procesos de obtención del fenol, y debido a esto, la Dow Chemical of Canada, Ltd., lo obtiene por medio de la oxidación del tolueno hasta ácido benzoico, y la reoxidación de éste para obtener fenol.

PROPIEDADES:
- FÍSICA:
Su Fórmula química es C6H5OH, y tiene un Punto de fusión de 43 °C y un Punto de ebullición de 182 °C. El fenol no es un alcohol, debido a que el grupo funcional de los alcoholes es R-OH,y en el caso del fenol es Ph-OH. El fenol es conocido también como ácido fénico o ácido carbólico, cuya Ka es de 1,3 • 10-10. Se puede detectar el sabor y el olor del fenol a niveles más bajos que los asociados con efectos nocivos. El fenol se evapora más lentamente que el agua y una pequeña cantidad puede formar una solución con agua. El fenol se inflama fácilmente, es corrosivo y sus gases son explosivos en contacto con la llama. El producto comercial es un líquido. Tiene un olor repugnantemente dulce y alquitranado.
- QUÍMICA:
Químicamente, el fenol, se caracteriza por la influencia mutua entre el grupo Hidroxilo u Oxidrilo (HO:) y el Anillo aromático. El grupo fenilo o fenil negativo, es la causa de una leve acidez del grupo oxidrílico (pK en solución acuosa a 25 ºC es 1.3 x 10 -10). En fenol reacciona con las bases fuertes para formar sales llamadas Fenóxidos (alguna veces fenonatos o fenolatos): C6H5-OH + NaOH H2O + C6H5-ONa Los fenatos de sodio y potasio, son rápidamente descompuestos por el bióxido de azufre; éste compuesto, también descompone al fenol. El Grupo hidroxilo puede ser fácilmente eterificado y eterificado. El acetato de fenilo CH3 = COO = C6H5, el fosfato de trifenilo (C6H5)3PO4 y el salicilato de fenilo (C6H5)2O son los éteres comerciales más conocidos del fenol. El fenol es rápidamente oxidado a una variedad de productos que incluye a los Bancenodioles (hidroquinona, resorcinol y pirocatecol), bencenotrioles y derivados del difenilo (difenoles ó bifenoles) HO-C6H4-OH, y óxido de difenilo (dibenzofurano) y productos de descomposición, dependiendo este del agente occidente y de las condiciones de operación. La reducción del fenol con zinc por destilación, da Benceno, y la hidrogenación del fenol, finalmente, es método para la obtención del Ciclohexanol. El grupo hidroxilo de una alta reactividad al grupo fenilo. Los átomos del hidrógeno en las posiciones o- (orto) y p- (para), con respecto del grupo hidroxilo, son altamente reactivos (orienta las sustituciones hacia esas posiciones); o sea, los hidrógenos en 2- y 4- son los primeros en ser sustituidas para formar el monodreivados para formar el monoderivado inicial, después el 2- 4- o el 2- 6- derivado, y finalmente el 2- 4- 6- triderivado, esto si las condiciones lo permite.

EJERCICIOS:
ALCOHOL 2
FENOL 1
FENOLES 2